科研就像賽跑�����,你比別人跑的快,就比別人多發(fā)幾篇SCI~
上一期,給朋友們帶來了
咱們書接上回��,繼續(xù)干貨奉上~
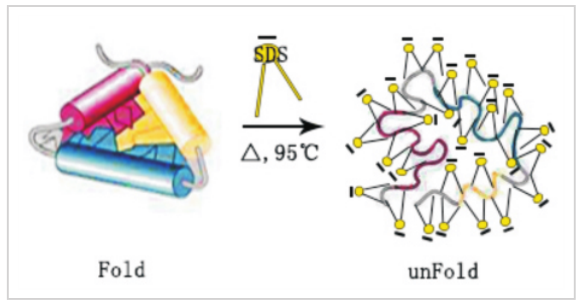
蛋白免疫印跡(WB)是基于抗原抗體的特異性結合作用�,以檢測復雜樣品中的某種蛋白���,并對其進行半定量分析的一種方法��。
主要用于靶標蛋白特異性表達的定性或半定量分析,蛋白與蛋白或蛋白與DNA相互作用的后續(xù)分析����,以及蛋白修飾的鑒定分析。
4.1 SDS-PAGE凝膠
利用丙烯酰胺和甲叉雙丙烯酰胺的聚合作用��,可以形成一種網狀的凝膠結構����,具有一定的分子篩作用。蛋白在大量SDS膠束包裹下���,形成SDS的電荷效應����,蛋白分子本身電荷被覆蓋,蛋白在電勢作用下�����,只與所包裹的SDS所帶負電荷相關�,即反映分子量大小。SDS-PAGE的分辨率與所使用交聯(lián)劑丙烯酰胺和甲叉雙丙烯酰胺的濃度相關���。不同濃度的交聯(lián)劑所形成的網狀分子篩孔徑不同���,形成分子篩效應。分離情況如下:
|
分離膠濃度
|
分離范圍(kDa)
|
|
8%
|
70-200
|
|
10%
|
25-70
|
|
12%
|
20-55
|
|
15%
|
15-45
|
✪ 丙烯酰胺凝膠的成分及作用
4.2 電泳液的配制與選擇
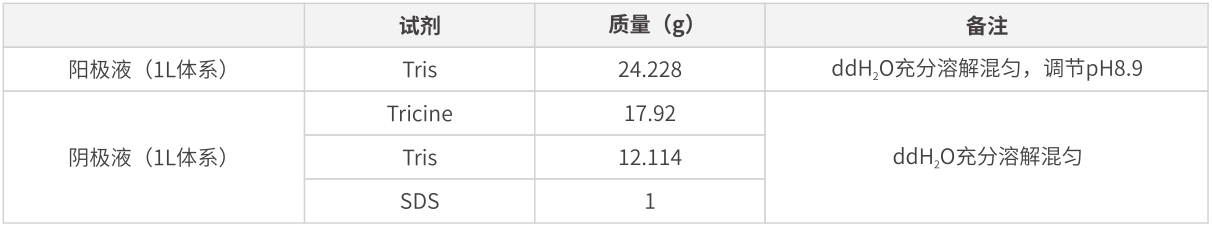
常規(guī)SDS-PAGE凝膠電泳對于分離30-250 kDa范圍內的蛋白具有較好的分離作用����,根據蛋白分子量大小的不同,參照分離情況表選擇合適的分離膠濃度��。1L電泳液配方如下:
使用Glycine-Tris-gel電泳體系時��,一般電泳條件為恒壓��,濃縮膠60-80 V��,分離膠100-120 V。電壓越小���,跑的越慢�����,分離效果更好���。
但對于分子量低于30 kDa的小分子蛋白,Glycine-Tris-gel體系分辨率不高����,無法達到相應的分離效果。Tricine相對于Glycine具有更好的電子遷移率和解離常數�,使得小分子蛋白在濃縮膠內具有更好的濃縮效應�,且在分離膠內具有更高的分辨率。所以�����,對于小分子蛋白推薦使用電泳液配方如下:
使用Tricine-Tris-gel電泳體系時���,一般條件為恒壓�����,電壓不宜過大����,60-100V左右。
4.3 Protein Marker 與內參選擇
在實驗過程中����,根據實驗需求需要設置相應對照。
◎ 分子量指示劑
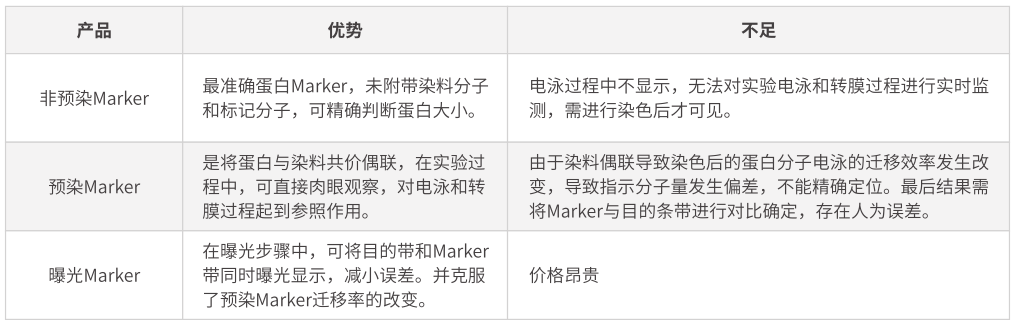
合適范圍的蛋白Marker�����,可指示蛋白分子量大小����,并在一定程度上反映電泳效果和轉膜效率。按照不同使用特性���,目前所使用的Marker大致可以分為3種:普通非預染Marker���、預染Marker、曝光Marker�����。
◎ 陽性對照
組織或細胞中已證實有相應蛋白表達的樣本即陽性對照品。
◎ 內參對照
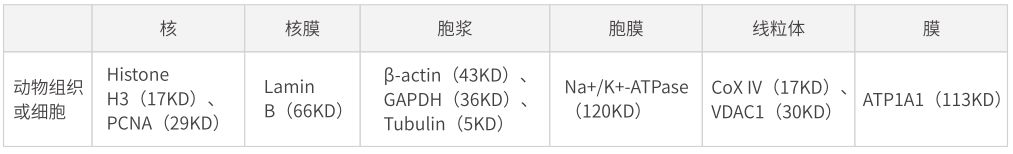
由于管家基因編碼表達的蛋白在各種組織和細胞中的表達量相對恒定��,故而在對蛋白進行定量檢測時����,需要將此類蛋白作為內參,以校正蛋白定量和上樣的誤差�����。另外�,內參蛋白還可以用于監(jiān)測整套實驗體系是否成功。
由于研究對象的不同��,需要根據實驗目的對內參蛋白進行選擇:
此外�����,在選擇內參蛋白時還應注意以下幾點:
1. 注意某些特定條件下的內參基因表達可能發(fā)生變化�,而不適于作為內參對照���。比如藥物誘導或者外界刺激存在時��,導致某些管家基因的表達量不再恒定����,而是發(fā)生一定變化。需要結合具體的實驗方案��,并查詢相關文獻綜合考慮��。
2. 目的蛋白與內參蛋白大小應存在差異��,便于檢測操作和區(qū)分���。如果選用的內參蛋白大小與目的蛋白大小相差不大時�,可以先進行目的蛋白的顯影�。隨后采用一抗二抗去除液洗去目的抗體,再進行內參抗體的孵育與顯影����。
◎ 轉膜方式膜介質的選擇
將電泳分離后的蛋白從凝膠中轉移到固相介質上,通常采用濕轉和半干轉���。兩種方法原理相同����,只是施加電場的機械裝置和用于固定膠與膜的方式有所不同,半干轉用浸潤緩沖液buffer的多層濾紙?zhí)娲?/span>兩種方法比較如下:
在轉膜時�,高電流作用下,短時間內裝置產熱非常明顯��,所以轉膜過程應采取相關措施�����,以保持低溫環(huán)境����。濕轉時,可以將裝置進行冰浴����,有利于散熱。半干轉時�����,不宜長時間進行電轉��,所以推薦大分子蛋白(100 kDa以上)采用濕轉�。對于小分子蛋白和正常分子蛋白��,濕轉與半干轉效率相差不大。對于高豐度�����,小塊膠����,建議干轉,提高效率��。低豐度�����,大塊膠���,建議濕轉��。
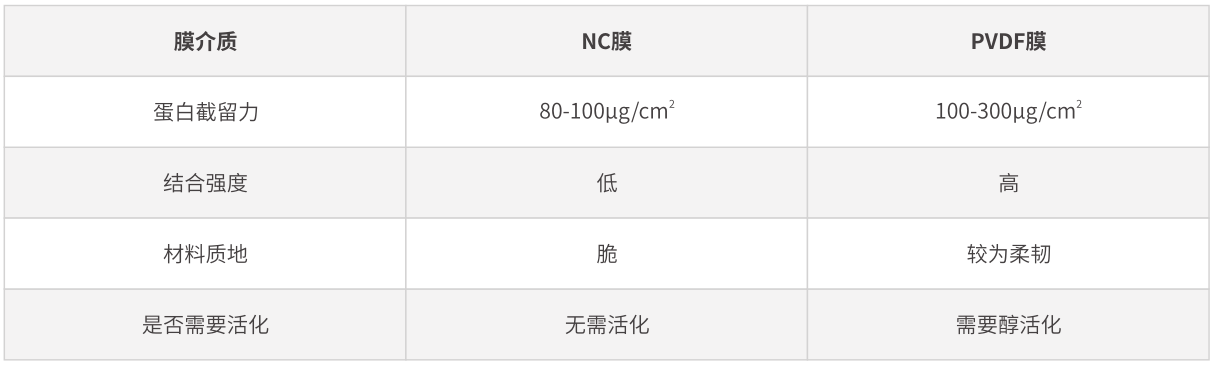
◎ 膜介質的選擇
轉膜過程中使用的膜介質����,目前使用最多的包括兩種��,即硝酸纖維素膜(NC膜)和PVDF膜��。
NC膜的結合能力主要是與其純度相關,純度越高��,與蛋白結合能力更強���。但純度高的NC膜較脆����,容易出現(xiàn)破碎的情況����。相對于NC膜,PVDF膜具有更強的蛋白結合能力�,且其具有更好的化學耐受性。
需要注意的是���,PVDF膜使用前����,需在甲醇中浸泡(>15 s)以活化膜上的正電基團�����,并在轉膜液中平衡一段時間。另外���,PVDF膜與NC膜都具有不同孔徑大小。對于小分子蛋白(<20 kDa)���,建議使用0.22 μm孔徑的膜���,避免出現(xiàn)轉過的現(xiàn)象。正常情況下使用0.45 μm孔徑的膜即可����。
◎ 蛋白分離與轉膜條件優(yōu)化
對于小分子蛋白的轉膜,可從以下幾點進行優(yōu)化:
1. 可以增大交聯(lián)劑濃度���,采用15%丙烯酰胺凝膠進行電泳�����。但對于15 Kda以下的蛋白�����,此膠的分辨率較低����,建議在濃縮膠和分離
膠之間增加10%的間層膠,以增加小分子蛋白分辨率��。
2. 采用Tris-Tricine電泳體系替代Tris-Glycine緩沖體系����,達到更好的濃縮作用與分離效果。注意應用該系統(tǒng)時��,電壓不宜過大��,60-80 V為宜�。
3. 選取0.22 μm孔徑的膜介質
4. 縮短轉膜時間,可采用干轉方式進行轉膜�。
對于大分子蛋白的轉膜,可從以下幾點進行優(yōu)化:
1. 降低交聯(lián)劑濃度���,采用8%-5%丙烯酰胺凝膠進行電泳�����,但需注意膠濃度越低���,越容易破碎���,操作時應小心。
2. 轉膜時����,電流適當調大,轉膜時間延長����,并避免轉膜過程中出現(xiàn)高熱����,推薦濕轉4℃過夜。
3. 適當降低轉膜緩沖液中的甲醇��,可促進膠中SDS分子與蛋白的分離��,高濃度的甲醇對蛋白有固定作用���,而不利于大分子蛋白泳出�����,可降低甲醇濃度至10%�����。
◎ 轉膜效率監(jiān)測
1. 預染Marker的轉膜情況在一定程度上反映了蛋白轉移效率����。
2. 對膠進行麗春紅染色,根據染色后的條帶查看是否轉膜成功�����。此過程為可逆過程����,但不適用于尼龍膜的染色。
麗春紅染色液的配制:5%(V/V)乙酸���,0.1%(W/V)麗春紅�,ddH2O混勻���,置于4℃保存�。
麗春紅染色流程如下:將轉膜后的PVDF膜或NC膜浸沒在麗春紅染色液中5-10min振蕩��。取出印跡膜�,用PBS洗滌3×5 min�����。觀察染色的紅色條帶�����,記錄轉膜情況����。再次使用PBS洗滌3×5 min�,以去除結合的麗春紅���,便于后續(xù)WB檢測��。
3. 對膠進行考馬斯亮藍染色�����,此染色過程不可逆�����,但考馬斯亮藍染色靈敏度較麗春紅高���。
考馬斯亮藍染色液的配制:10%(V/V)冰醋酸�����,45%(V/V)甲醇���,0.25%(W/V),ddH2O混勻�����。
考馬斯亮藍脫色液的配制:25%(V/V)甲醇��,8%(V/V)冰醋酸�����,ddH2O混勻��。
考馬斯亮藍染色流程如下:將轉膜后的PVDF膜或NC膜浸沒在考馬斯亮藍染色液中����,置于水平搖床上緩慢搖動,室溫染色1 h(根據膠大小�、厚度和溫度調整)�,至膠染成藍色����。倒出染色液,將膠浸入脫色液中�����,置于水平搖床上緩慢搖動���,室溫脫色4 h�����,至藍色背景脫去�,蛋白條帶可見����。
◎ 轉膜緩沖液的配制
1L轉膜緩沖液配制如下:
轉膜buffer需避光保存��,可重復使用多次����,但由于甲醇較易揮發(fā)�����,應及時更換使用新鮮轉膜緩沖液����。
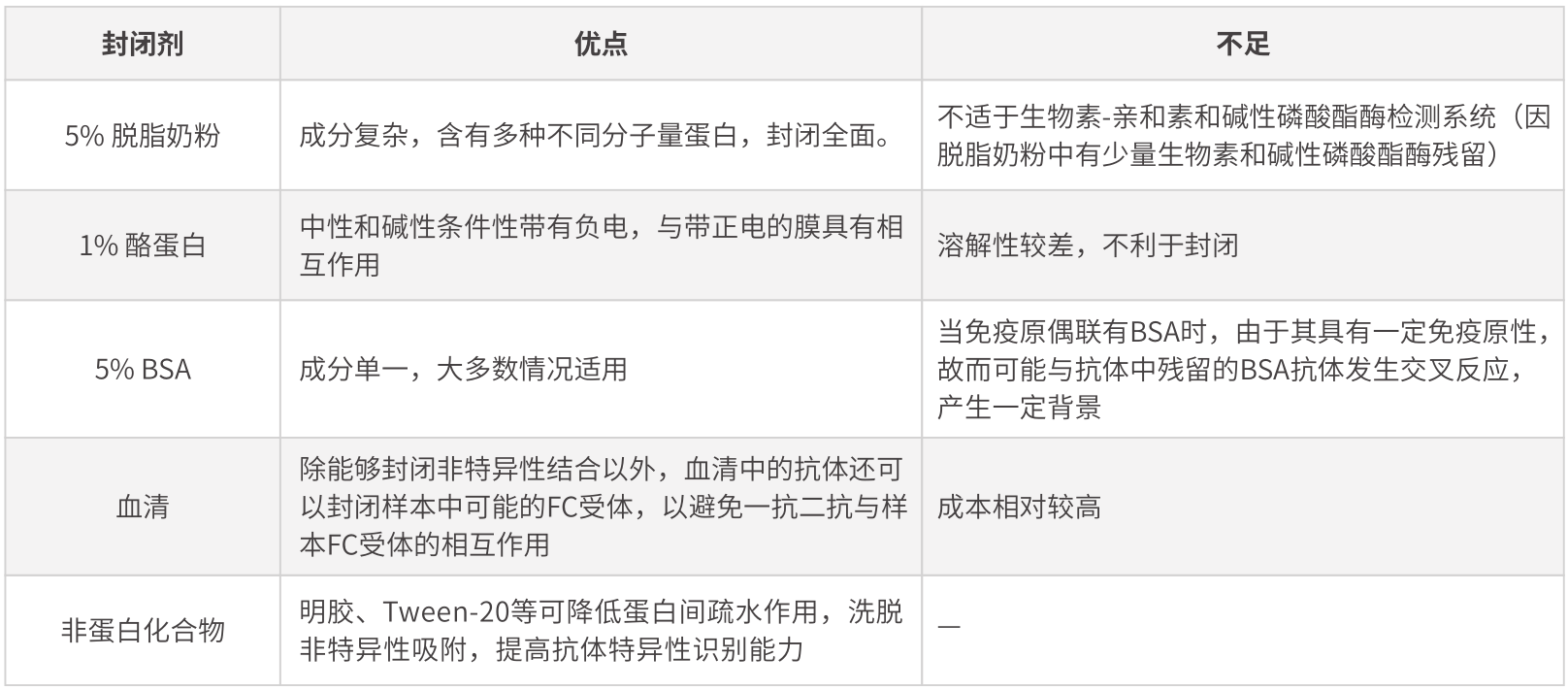
◎ 封閉劑的選擇
固相介質表面材質不均一�,有很多細小孔洞。當蛋白被轉移至固相介質以后���,通過非共價作用力吸附于固相介質表面����。但并不是所有位點都吸附了蛋白�,故需要將封閉劑吸附到固相介質上,以避免抗體分子直接吸附到膜上����,產生假陽性或者高背景的結果。
選擇封閉劑的原則是封閉劑應能夠封閉膜上所有未結合位點��,而不干擾目的蛋白的結合���,且不與靶蛋白表位進行結合����,不與抗體及其他試劑有交叉反應。
常用封閉劑如下:
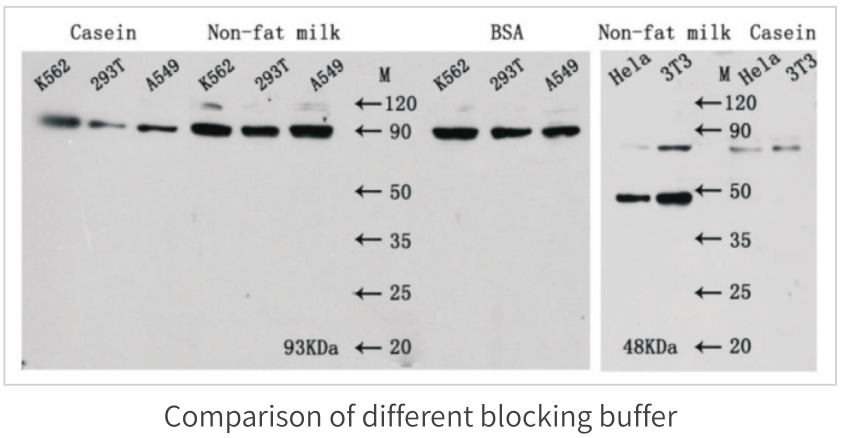
不同封閉劑的比較實驗如下:
需要特別注意的是���,對于磷酸化的蛋白�����,進行檢測時不建議使用脫脂奶粉和酪蛋白作為封閉劑����,并使用TBST替代PBST����。對于封閉劑的選擇需要根據結果情況進行相應調整,對于大部分抗體在用脫脂奶粉時�,可以達到好的封閉效果,但有些抗體在使用BSA封閉時����,能夠更好的降低背景����。封閉條件一般為室溫振蕩封閉1h�����。
按照產品說明��,對一抗進行適當稀釋�,一抗稀釋液一般與封閉劑組分相同����。另外,建議
選擇已有驗證的一抗��。另外���,一抗建議4℃孵育過夜����,使抗原抗體充分結合�。
對于一抗稀釋比例最好做梯度預實驗,以確定最佳稀釋比例����。此時可采用簡單的Dot blot法進行摸索。使用NC膜,在膜上依次點上不同上樣量的樣本�,自然風干。待膜完全吸收樣本后����,進行封閉。隨后��,按上樣梯度對膜進行裁剪����,分別采用不同濃度梯度的一抗孵育,相同二抗孵育�。最后ECL發(fā)光底物孵育顯影。觀察顯影情況進行抗體稀釋比范圍的初步判定��。
◎ 實驗操作
1. 二抗孵育前��,用PBST/TBST洗膜3×10 min��,以去除未結合的一抗����。
2. 對二抗進行適當稀釋,室溫孵育1h�。
3. 二抗孵育完成后��,用PBST/TBST洗膜3×10 min,以去除未結合的二抗�,再進行后續(xù)實驗。
◎ 二抗選擇
1. 物種來源
不建議選擇來源于鼠或兔來源的二抗����,因其與人的同源性較大,容易發(fā)生交叉反應���,導致高背景���。常使用羊或驢來源二抗,所使用二抗必須與一抗種屬來源不同���,且需根據一抗種屬選擇抗該種屬的二抗���。另外,還應注意所使用單克隆一抗的亞型�,選擇針對一抗亞型的二抗。
2. 純化方式
對于目前抗體純化方式主要有Protein G/A純化和抗原親和純化�����。前者可與血清中所有抗體IgG分子發(fā)生結合,抗原特異性無區(qū)分��。后者是通過能夠與抗體特異性識別的配體或者受體來進行結合洗脫��,可以純化血清中的特異性抗體成分���。所以����,親和純化二抗可大大減少非特異性結合��,提高蛋白的檢測特異性�。
3. 合適的標記物
WB中最常使用二抗標記物為酶標二抗,如辣根過氧化物酶HRP和堿性磷酸酯酶AP����。HRP特異性強,作用底物較為廣泛�����,經濟快速�����,且穩(wěn)定。AP雖然更為靈敏��,但其背景往往更高����,且在實驗樣本中可能存在的內源性磷酸酯酶會干擾實驗結果�。另外,使用AP標記二抗時���,封閉劑也應謹慎選擇�,避免磷酸酯酶的干擾��。
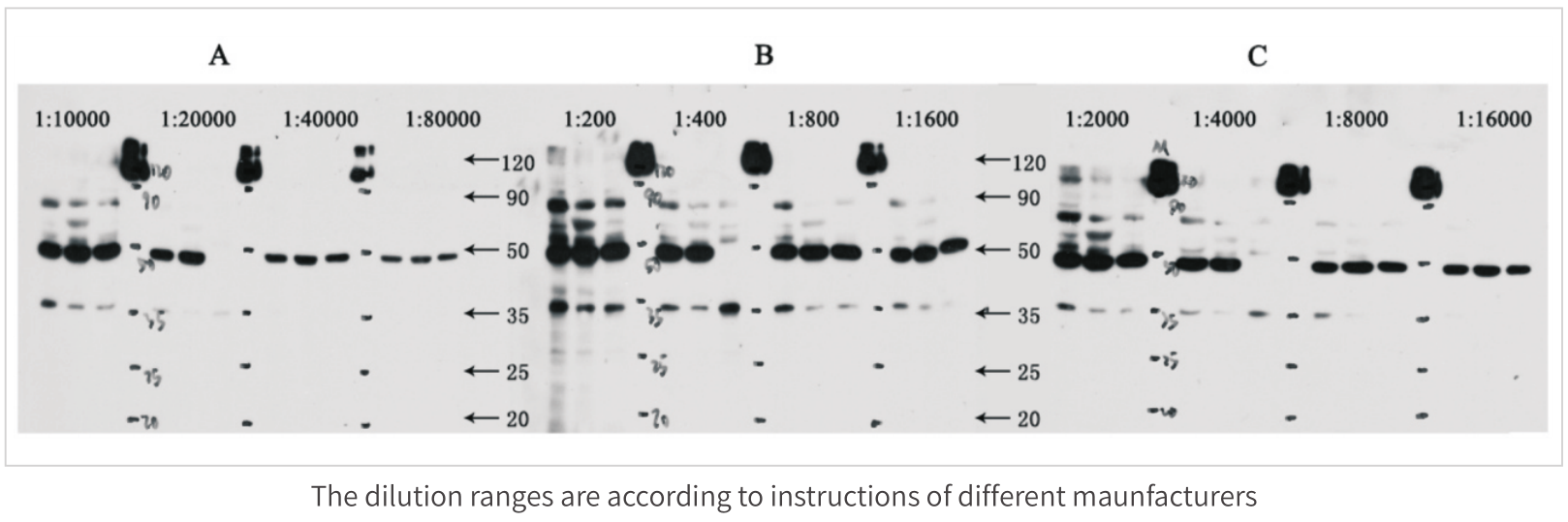
不同廠家二抗(HRP標記)的比較實驗如下:
1. 化學發(fā)光顯色
最為經典的HRP化學發(fā)光底物Luminol���,在H2O 存在下����,與辣根過氧化物酶發(fā)生酶促反應�����,發(fā)出熒光���,靈敏度高��,成像性好����,可在膠片上進行顯影。
2. 底物顯色
HRP的生色底物有多種��,其中最常用的是DAB���,其通過與HRR反應生成不溶性棕褐色沉淀而顯色���,其靈敏度高,但需要現(xiàn)配現(xiàn)
用����,且具有致癌性,操作時應小心操作���。
3. 熒光顯色
通過使用合適的熒光二抗���,可實現(xiàn)熒光二抗顯影,彌補了化學發(fā)光和底物顯色的定量缺陷��。
實驗流程基本就到這了
~下期常見問題解答專屬奉上喲~
1.蛋白樣品準備
2.蛋白定量
3.上樣
4.凝膠電泳
5.轉膜
6.封閉
7.孵育一抗
8.孵育二抗
9.顯影
10.常見問題
—未完·待續(xù)—
——華美生物·讓科研變得有溫度!——
掃碼關注官方微信�����,后臺回復【實驗技術WB】
免費下載實驗手冊�����,精彩內容搶先掌握��!