科研就像賽跑�����,你比別人跑的快����,就比別人多發(fā)幾篇SCI~
前兩期,給朋友們帶來了
做了很久的WB�,走了很多彎路,但是WB想要做好并不難�,總結WB實驗中可能會遇到的問題,分析可能的原因及對應的解決方案�,才是實驗成功的基石。
蛋白免疫印跡(WB)是基于抗原抗體的特異性結合作用���,以檢測復雜樣品中的某種蛋白�,并對其進行半定量分析的一種方法。
主要用于靶標蛋白特異性表達的定性或半定量分析���,蛋白與蛋白或蛋白與DNA相互作用的后續(xù)分析����,以及蛋白修飾的鑒定分析����。
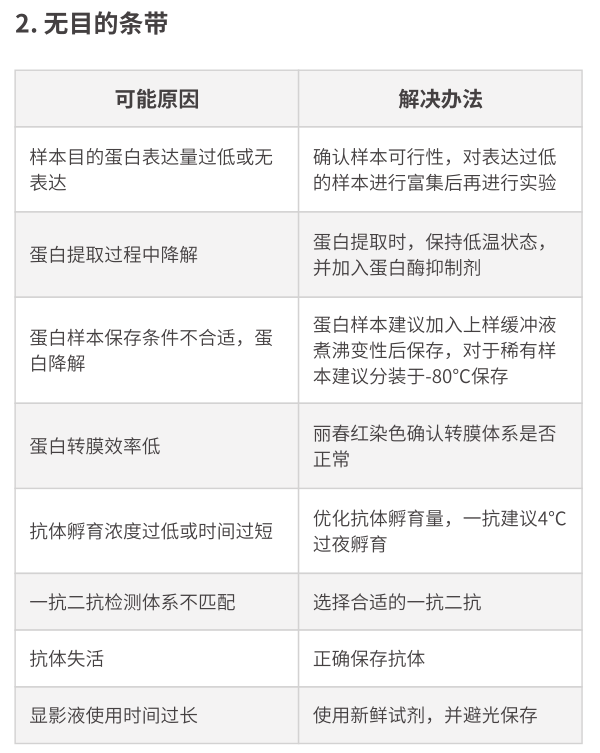
1.為什么我的細胞提取液中沒有檢測到目的蛋白?
原因有很多:
a) 細胞中不表達這種蛋白質���,換一種細胞����;
b) 細胞中的蛋白質被降解掉了�,可加入蛋白酶抑制劑,抑制蛋白酶活性���;
c) 抗體不能識別目標蛋白�,多看看說明����,是否有問題���;
d) 酶降解可能是沒有保持低溫操作,樣品保存不當�,樣品放置時間過長。
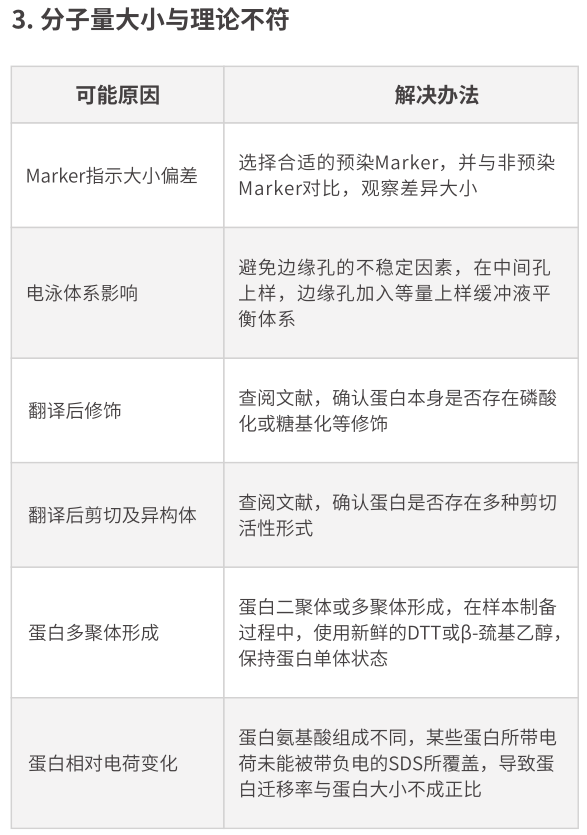
2.我做的蛋白質分子量很?��。?0 kDa)�����,請問怎么做WB��?
a)可以選擇PSQ膜�����,同時縮短轉移時間。也可以將兩張膜疊在一起���,再轉移�����。其他按步驟即可����;
b)也可選擇孔徑0.22 μm的PVDF膜或者NC膜,轉膜時間縮短�����,另外可采用Tricine-SDS-PAGE體系��。
3.我的目的帶很弱�����,如何加強��?
a)可以加大抗原上樣量��,這是最主要的���;
b)也可以將一抗稀釋比例降低���;
c)還可以延長曝光時間。
4.DAB好還是ECL好���?
DAB 有毒��,但是比較靈敏���,是HRP 最敏感的底物�����;
ECL結果容易控制�����,但被催化時靈敏度差一點�,但如果達到閥值�,就特別靈敏,可以檢測pg 級抗原����。
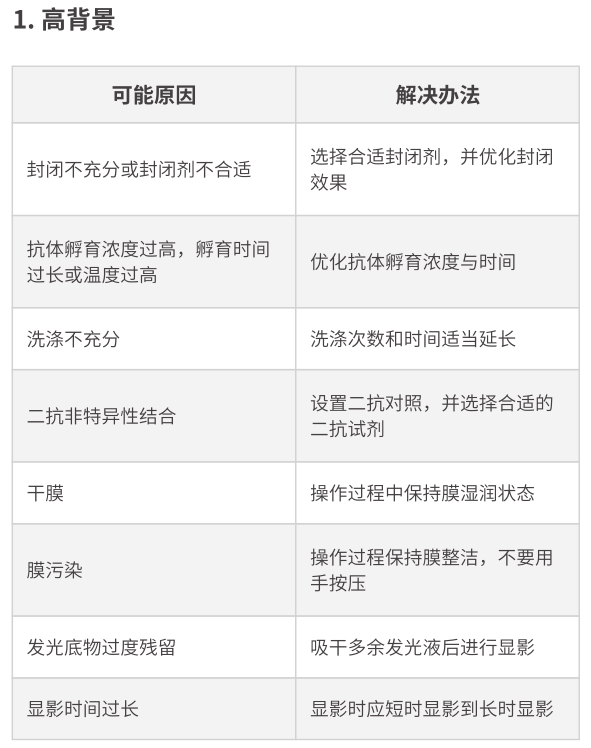
5.膠片是一片空白,是怎么回事���?
如果能夠排除下面的幾個問題那么問題多半出現(xiàn)在一抗和抗原制備上。
a) 二抗的HRP 活性太強���,將底物消耗光����;
b) ECM底物中H2O2,不穩(wěn)定�����,失活����;
c) ECL底物沒覆蓋到相應位置;
d) 一抗選擇不當二抗失活���;
e) 二抗失活�。
6.磷酸化抗體的檢測樣本制備時是否一定要加NaF等�?
NaF是一種廣譜磷酸化酶的抑制劑,一般最好加���。但是不加也可以����,大部分時候是不用加的���。
7.細胞水平要做WB��,多少細胞提的蛋白夠做WB���?
一般5×10^6就足夠��。
8.如果上樣量超載�,要用什么方法來增加上樣量����?
可以濃縮樣品,也可以根據(jù)目標分子量透析掉一部分小分子蛋白����。一般地,超載30%是不會有問題的����。如果已經(jīng)超了不少了,而且小分子量的也要��,可以考慮加大膠的厚度��,可以試試1.5 mm的��。
9.大分子量蛋白200 kDa��,在做WB要注意什么�����?
a) 做200kDa蛋白的WB時要注意���,分離膠最好選擇>7%的��;剝膠時要小心�;
b) 轉移時間需要相應延長�;要做分子量參照(否則出現(xiàn)雜帶不知道如何分析)。
c) 轉膜液中甲醇含量可適當降低�����,推薦使用濕裝轉膜效率更高哦!
10.免疫組化和WB可以用同一種抗體嗎��?
免疫組化時抗體識別的是未經(jīng)變性處理的抗原決定簇(又稱表位)��,有些表位是線性的����,而有的屬于構象型�����;線性表位不受蛋白變性的影響���,天然蛋白和煮后的蛋白都含有;構象型表位由于受蛋白空間結構限制��,煮后變性會消失����。如果所用的抗體識別的是蛋白上連續(xù)的幾個氨基酸,也就是線性表位����,那么這種抗體可同時用于免疫組化和WB,而如果抗體識別構象形表位�,則只能用于免疫組化。
11.WB中抗體的可以重復應用嗎���?
抗體工作溶液一般不主張儲存反復使用�,但是如抗體比較珍貴��,可反復使用2-3次。稀釋后應在2-3天內(nèi)使用��,4℃保存�,避免反復凍融。
12.上下槽緩沖液有何要求���,怎樣才能達到最佳效果?
無特殊要求����。但一般是上槽放新鮮的緩沖液,下槽可以是重復使用過一兩次的緩沖液��。
此次給大家?guī)淼母韶浀酱私Y束啦
~掌握十個小節(jié)內(nèi)容趕緊下載手冊吧~
1.蛋白樣品準備
2.蛋白定量
3.上樣
4.凝膠電泳
5.轉膜
6.封閉
7.孵育一抗
8.孵育二抗
9.顯影
10.常見問題
后臺回復【實驗技術WB】
免費下載實驗手冊����,精彩內(nèi)容立刻掌握!
—END—
——華美生物·讓科研變得有溫度���!——